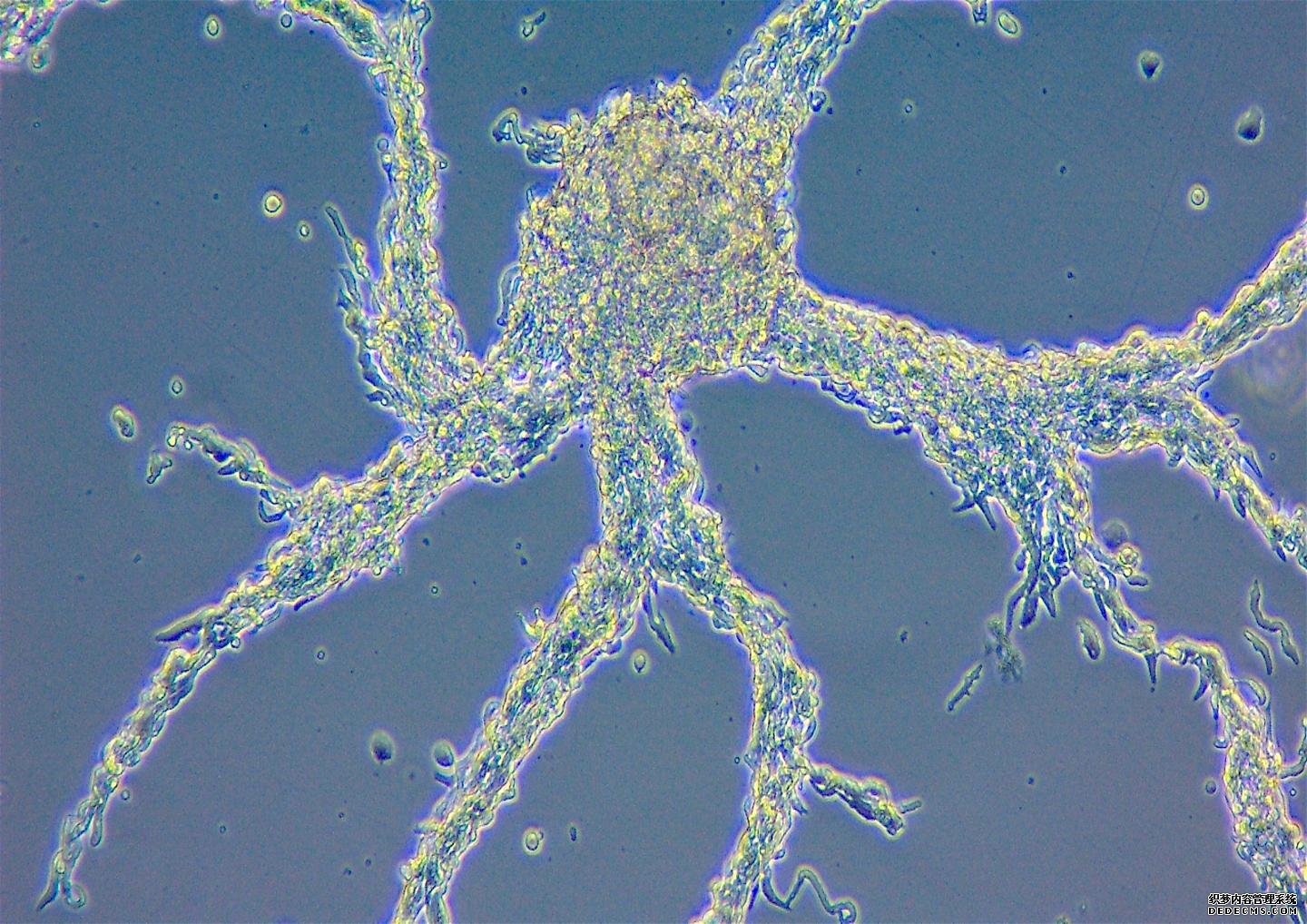
从单细胞生物到多细胞生物的转变是复杂生命形式进化的重要一步。多细胞生物产生于数亿年前,但这一事件背后的力量仍然是个谜。为了研究多细胞生物的起源,埃里卡·皮尔斯(Erika Pearce)在弗莱堡的免疫生物学和表观遗传学MPI的团队转向黏菌盘基网柄菌(Dictyostelium discoideum),它既可以以单细胞状态存在,也可以以多细胞状态存在,处于这一关键进化步骤的尖端。这些截然不同的状态只依赖于一样东西——食物。
皮尔斯实验室的核心问题是回答代谢变化如何驱动细胞功能和分化。通常,他们研究免疫细胞来回答这个问题,然而,当第一作者贝丝·凯利加入这个小组时,他们决定转移焦点。“我们认为,如果我们对营养有效性如何引起细胞功能变化感兴趣,杏耀那么没有比Dicty更好的生物来研究了,在Dicty中,饥饿会导致细胞从自身存在到形成多细胞生物。这是生物学上的一个巨大转变,”艾丽卡皮尔斯说。
饥饿促使这种群居变形虫多细胞聚集
仅仅通过剥夺D. discoideum的食物供应,他们就可以把这个生物从单细胞变成多细胞的聚集体,让他们检查驱动这种多细胞生物的因素。聚集物表现为一个复杂的多细胞有机体,单个细胞具有不同的功能,并作为一个整体移动。多细胞盘状芽孢最终会形成一个保护性的孢子,使种群在饥饿中存活下来。
饥饿条件下,盘状芽孢杆菌能迅速产生活性氧(ROS)。ROS是由我们的细胞产生的小分子,但在更复杂的、基于受体的系统存在之前,也曾在进化早期用于信号传导。然而,当ROS水平过高时,它们会产生破坏性,氧化蛋白质和核酸,最终导致细胞死亡。因此,活性氧的增加通常伴随着抗氧化剂的产生来控制这些活性氧。贝丝·凯利指出:“在我们的研究中,抗氧化剂谷胱甘肽的产生增加了,以对抗饥饿时大量ROS的爆发。如果我们给饥饿的黏菌额外的谷胱甘肽,我们能够阻止ROS的增加,重要的是,阻止多细胞聚集的形成,使细胞保持在单细胞状态。”
饥饿改变了他们的新陈代谢
反过来,当他们用一种抑制剂阻止谷胱甘肽的产生时,他们发现非但没有促进更快的聚集,反而逆转了它,使单细胞状态维持得更久。这表明,除抗氧化活性外,补充谷胱甘肽的某些功能逆转了聚集过程。他们仔细研究了谷胱甘肽是如何产生的。它只由三种氨基酸组成:半胱氨酸、甘氨酸和谷氨酰胺。Kelly将这些成分分别添加到饥饿细胞中,她发现只有半胱氨酸才能逆转饥饿时的多细胞聚集。
半胱氨酸生物学的独特之处是什么?它是仅有的两种含有硫的氨基酸之一,这种硫对细胞增殖的各种过程至关重要。它被用来制造新的蛋白质,对酶活性至关重要,并支持新陈代谢过程以产生能量。因此,限制半胱氨酸就限制了硫的供应,减缓了生长和增殖,并表明没有足够的营养来继续这些过程。对于盘基网柄菌来说,这意味着它们应该转变成多细胞状态,形成能在营养限制时期存活的孢子,从而保护种群。
硫决定了细胞的功能和多细胞性
结果证明硫的丢失是这种多细胞生物背后的重要过程,而增加ROS是D. discoideum实现这一目标的聪明手段。通过增加ROS,饥饿的盘基网柄细胞因此增加了谷胱甘肽的生产。“这实际上将细胞中的半胱氨酸拉入谷胱甘肽,限制了其用于增殖和蛋白质生产的硫的使用。”通过人工阻止谷胱甘肽的产生,或者通过向饥饿的细胞提供额外的半胱氨酸,我们可以恢复硫供应,恢复增殖和单细胞状态,”贝丝·凯利说。“因此,杏耀平台我们揭示了硫如何决定单细胞和多细胞状态之间的转换。”硫和氧是古代世界常见的小元素,这项研究揭示了它们在多细胞生物起源中扮演的角色。
“除此之外,我们认为我们的工作对更复杂的生物体有治疗意义。癌细胞是高度增殖的,一些癌细胞专门保存硫代谢。限制或靶向这些细胞中的硫代谢过程可能会增强抗肿瘤免疫,”皮尔斯说。免疫细胞在含有不同营养混合物的环境中穿行,免疫细胞的功能依赖于代谢途径的活性。操纵硫代谢可能是调节免疫细胞功能的一种手段。总之,在早期真核生物盘基网柄菌中检测这些保守的营养信号通路可能对研究哺乳动物细胞功能具有重要意义。









