来自大阪大学科学与工业研究所和广岛理工学院的研究人员宣布,杏耀招商他们发现了一种新的蛋白质,这种蛋白质可以让生物体进行初步和必要的步骤,将交联多肽上的氨基酸残基转化为酶辅因子。这项研究可能导致更好地理解生物化学在细胞中潜在的催化作用。
每个活细胞都伴随着一系列的生物化学反应不断跳动。这些反应的速率是由一种叫做酶的特殊蛋白质控制的,酶可以催化某些特定的过程,否则需要更长的时间。许多酶需要一种叫做“辅助因子”的特殊分子,这种分子可以在氧化还原反应中帮助电子来回穿梭。但是这些辅助因子本身必须由生物体产生,并且常常需要先前存在的蛋白质的协助。
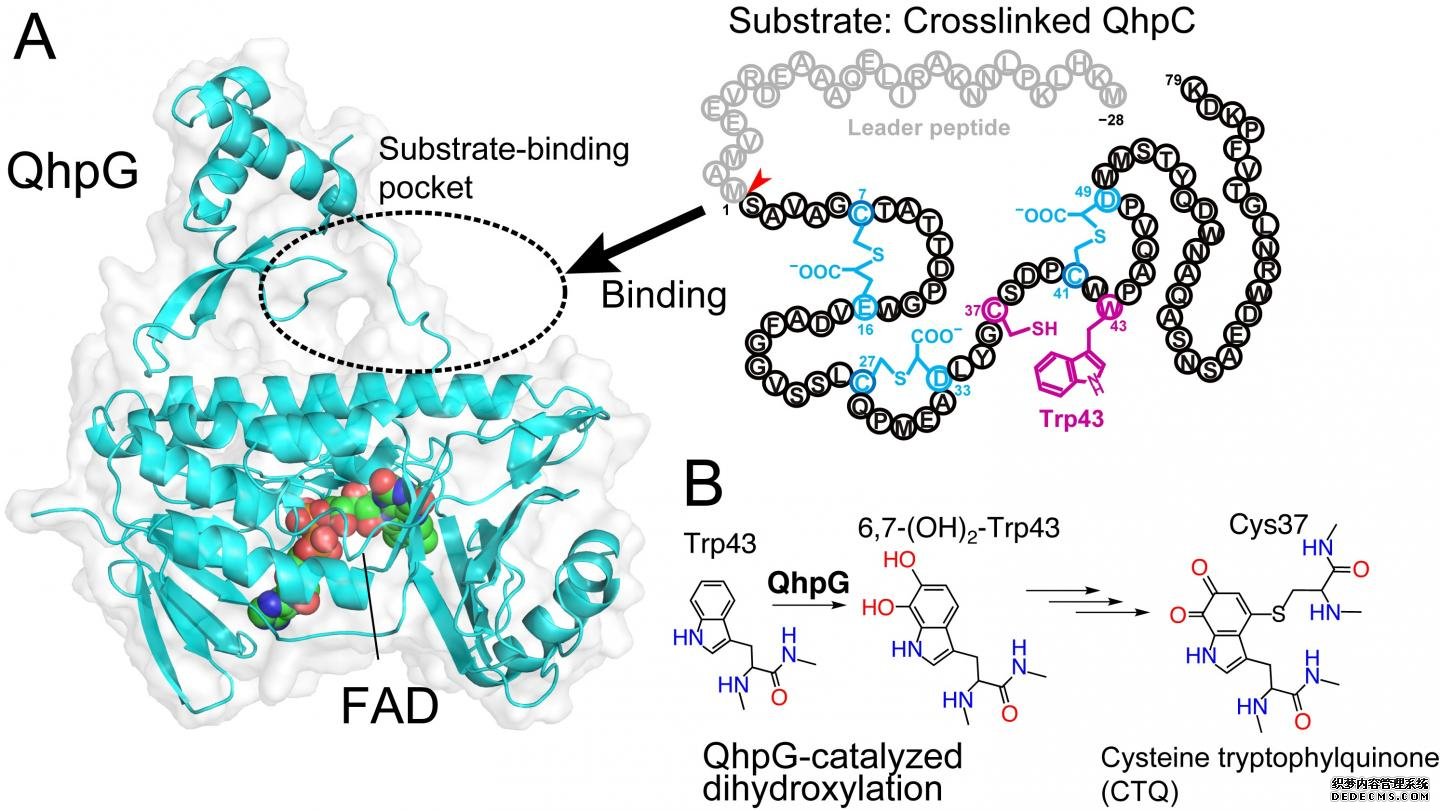
现在,大阪大学的一组科学家发现了一种名为QhpG的新蛋白质,它对酶辅因子半胱氨酸色氨酸醌(CTQ)的生物发生至关重要。通过分析反应产物的质量及其晶体结构决定,他们能够演绎QhpG的催化功能,增加两个羟基的活性部位中的一个特定的色氨酸残基quinoheme蛋白质的亚基QhpC胺脱氢酶、各种主要的细菌酶催化氧化胺。由此产生的二羟基色氨酸和邻近的半胱氨酸残基最终转化为辅因子CTQ。
然而,与其他蛋白修饰酶相比,QhpG的作用有些不同寻常,因为它与另一种酶QhpD三交联的QhC上的色氨酸残基发生反应,这一过程称为翻译后修饰。色氨酸自然含有带有共轭键的环,它需要最少的变化才能成为醌的辅因子。主要作者Toshinori Oozeki说:“虽然已知几种酶含有色氨酸残基衍生的醌辅因子,
杏耀客服怎么联系,但其翻译后修饰的机制以及其生物发生过程中酶的结构仍不清楚。”
这些蛋白质是通过将带有相应基因的质粒导入大肠杆菌并制成晶体而获得的。晶体的x射线衍射数据可以确定QhpG蛋白的结构。然后,基于他们发现的QhpG的晶体结构,该团队使用计算机软件模拟目标分子的对接,杏耀招代理即三交联多肽QhpC。QhpC的两种翻译后修饰依次在修饰酶复合物QhpD-QhpG中进行。资深作者冈岛俊英说:“我们的发现可以应用于利用修饰氨基酸的酶开发新的生物活性肽。”其中一些应用包括创造用于有毒化学物质生物修复的新酶。









