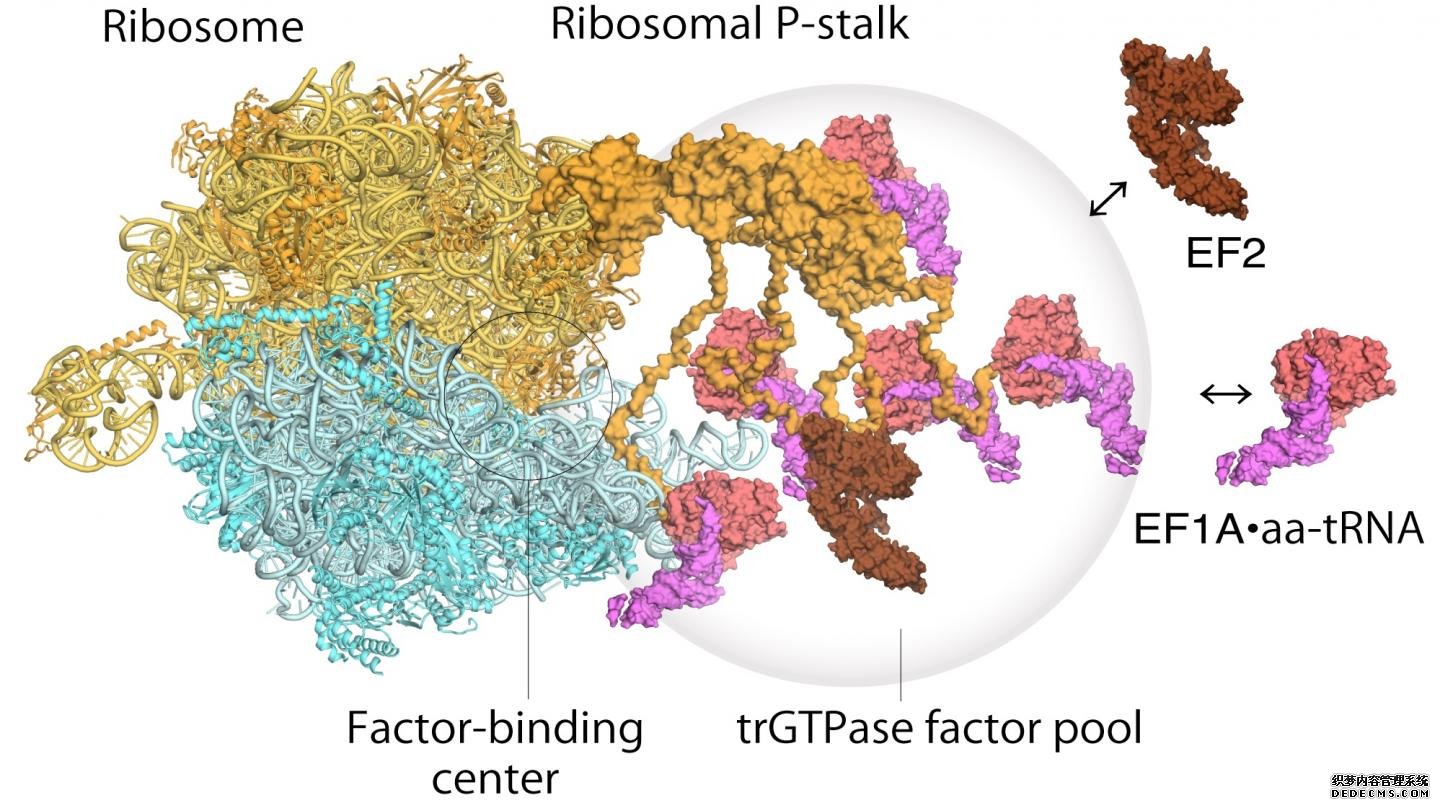
核糖体是核糖核蛋白的复合物,是细胞内蛋白质合成的核心。然而,杏耀游戏玩家在缺乏确凿证据的情况下,这些综合体是如何运作的一直存在争议。现在金泽大学的今井博广和小寺Noriyuki Kodera,以及日本新泻大学的内池俊夫,展示了核糖体在构建新蛋白质时发生的结构动力学和因子池化的可视化。
核糖体于20世纪50年代首次被发现,人们对其广泛功能的认识已经有一段时间了——它们可以读取信使RNA序列,并由此产生正确排序的氨基酸序列,形成新的蛋白质。特别是核糖体的蛋白质在蛋白质合成过程中发挥着不可或缺的作用,它通过招募负责翻译和延伸氨基酸序列的蛋白质因子。然而,由于结合的核糖体蛋白具有一定的灵活性,杏耀注册 ,因此很难准确地确定其结构。在这里,高速原子力显微镜的高分辨率和快速图像捕捉被证明是无价的。
原子力显微镜使用纳米级的尖端来感受样品,很像黑胶唱机针头扫描唱片,只是原子力显微镜识别的细节可以具有原子级的分辨率。该技术在不同表面上的多功能性已经是生物研究的巨大优势,但随着高速原子力显微镜的出现,该技术也第一次能够捕捉动态过程。Imai, Uchiumi和Kodera利用这项技术揭示了茎蛋白质实际上在两种构象之间翻转——一种与先前的结构模型一致,另一种完全出乎意料的新构象。
至于核糖体是如何运作的,先前提出了两步机制来描述遗传信息是如何通过被称为“翻译GTPase因子”的蛋白质翻译的。第一步是将因子招募到蛋白柄上的因子栓结位点,从而增加因子的集中,即所谓的因子池化。第二步是将翻译GTPase与核糖体因子结合中心结合并稳定,杏耀注册以催化GTPase水解。通过他们的高速原子力显微镜研究,研究人员能够获得第一个视觉证据,翻译GTPase因子池机制的核糖体柄。
虽然这项研究无法给出这些因子结合后作用的确凿证据,但研究人员确实注意到,一旦GTPase水解完成,这些因子似乎就保留在附近,这表明了秸秆蛋白在蛋白质合成的进一步阶段中可能发挥的作用。研究人员总结道:“HS-AFM的未来工作将为理解这些复杂的平移机械的动态行为提供更重要的信息。”









