准确地知道蛋白质在哪里受挫,可以为生产更好的药物提供很长的一段路。
这是莱斯大学科学家进行的一项新研究的结果,该研究旨在寻找稳定或破坏生物分子关键部分的机制。
Atom-scale模型由大米理论家彼得•Wolynes作者和校友Mingchen陈和他们的同事理论生物物理学中心表明,不仅是一些特定的沮丧在蛋白质序列需要允许他们功能,定位他们还提供线索来实现更好的特异性药物。
Wolynes说,这些知识也可以帮助设计出副作用更少的药物。
该团队的开放获取研究发表在《自然通讯》上。
原子尺度模型将重点放在可能结合位点内的相互作用上,
杏耀娱乐防劫持教学,杏耀代理而不是蛋白质中绝大多数引导折叠的相互作用上。更精细的分辨率模型允许加入辅助因子,如化学活性配体,包括药物分子。研究人员说,这种能力使我们对为什么配体最好被特定的蛋白质捕获而不是被其他蛋白质捕获有了新的见解。
“非自然配体”,也就是药物,倾向于最好地与蛋白质中那些受挫的囊袋结合,一旦药物结合,这些囊袋就会最小化受挫,Wolynes说。找到一种方法,然后了解这些最低限度受挫网站的细节,将有助于制药公司消除大量的试验和错误。
“药物设计的标准方法是在一个蛋白质上试验10,000个结合位点,以找到合适的,”Wolynes说。“我们的意思是,你不需要对所有可能的结合位点进行采样,只需要一个相当合理的数量就可以理解在局部环境中什么可以起作用的统计数据。
他说:“这是进行民意调查和实际进行选举之间的区别。“投票比较便宜,但你还是需要去核实。”
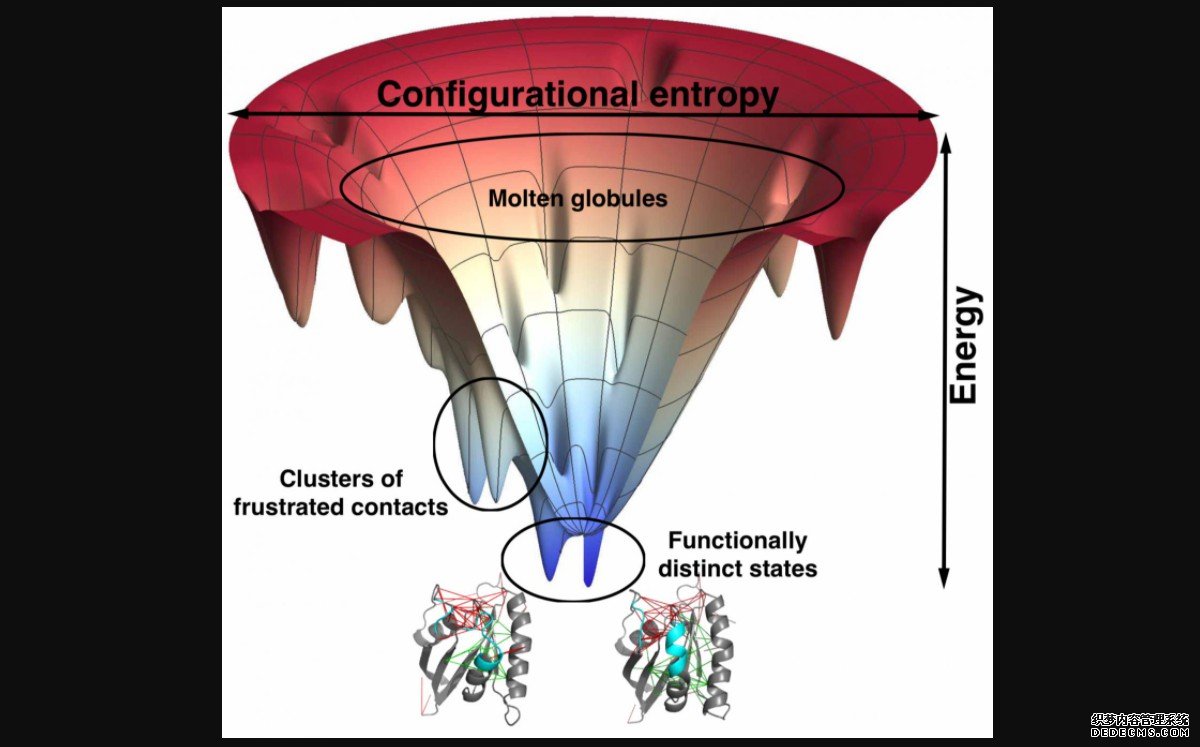
莱斯大学的研究人员以他们关于蛋白质折叠的能量景观理论而闻名。它通常采用粗粒度模型,其中氨基酸仅由几个位点表示。
与试图确定每个残留物中每个原子随时间的位置相比,这种策略需要更少的计算能力,但它在根据序列预测蛋白质折叠方面被证明是非常准确的。但在这项研究中,研究人员在原子水平上模拟了蛋白质和蛋白质配体复合物,看看他们是否能发现挫折是如何使蛋白质的某些部分具有与其他分子结合所需的灵活性的。
“全原子分辨率模型的一个伟大之处在于,它允许我们评估药物分子是否适合结合位点,”Wolynes说。这种方法能够快速显示某一药物的结合位点是否会受到最小程度的阻碍,或者仍然是阻碍区域。如果在分子结合后,该位点仍然不稳定,蛋白质可能会重新排列,或者药物可能改变其方向,从而导致副作用。”
建模受挫的位点——有时改变它们看看会发生什么——让研究人员看到药物特异性如何与结合袋相关。他们写道,挫折分析为“筛选更具体的化合物以发现药物提供了一条途径。”
“这种沮丧的概念在我们研究蛋白质折叠的一开始就存在,”Wolynes说。“当我们将其应用于真正的蛋白质分子时,我们发现了一些例子,其中折叠机制违背了我们从完美漏斗中预测的结果。然后我们发现这些与漏斗图的偏差发生在蛋白质的位置,事实上,有些令人沮丧。
“这就像一个例外证明了规则,”他说。一些一直正确的事情可能是琐碎的。但如果有1%的情况不是这样,这就是一个有待解决的问题,而我们已经能够通过我们的结构预测软件AWSEM做到这一点。”
正如该小组在最近的另一篇论文中所描述的那样,杏耀可以扩展该软件以在原子级别上分析挫折。但是追踪蛋白质中每个原子的计算成本是如此之高,以至于研究人员需要找到一种方法来对特定区域的运动进行采样,因为这些区域的运动可能会扰乱折叠路线。
Wolynes说:“Mingchen意识到有一种有效的算法可以在结合位点采样当地环境,同时保持原子分辨率。”他指出,他和Chen现在在私营企业,正在使用这些模型来研究可能的治疗方法,包括covid -19相关药物。









