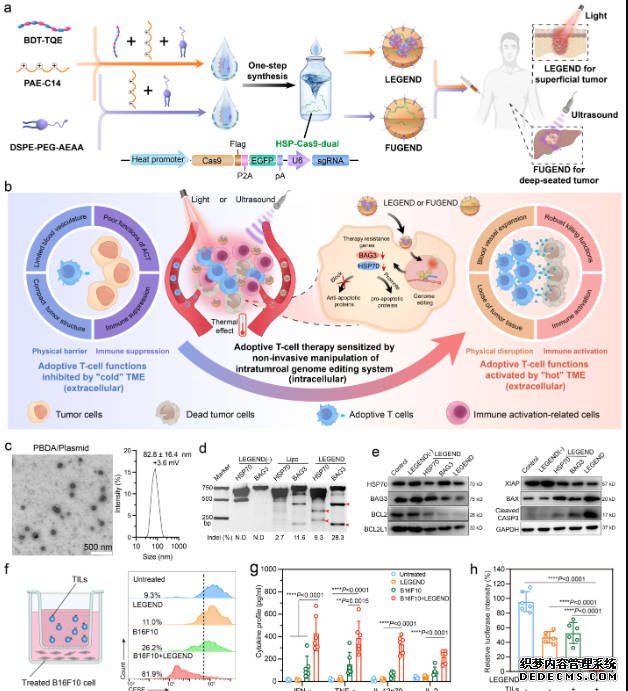
过继T细胞转移(adoptive T-cell transfer,ACT)疗法是极具前景的肿瘤免疫疗法,但对实体瘤效果欠佳。
针对这一问题,中国科学院过程工程研究所(以下简称过程工程所)生化工程国家重点实验室魏炜团队与浙江大学药学院平渊团队展开交叉合作研究,二号站平台登录
通过非侵入手段激活实体瘤的基因编辑,并同时调控实体瘤物理和免疫微环境,显著提升了多种ACT疗法对实体瘤的疗效。5月15日,相关工作在《自然-纳米技术》(Nature Nanotechnology)上发表。
光/声非侵入手段激活瘤内基因编辑增效ACT疗法的作用机制(研究团队供图)
ACT疗法通过获取患者自身T细胞进行体外改造,使其回输患者体内后识别并攻击肿瘤细胞。然而,由于实体瘤细胞内的凋亡抗性保护其免于T细胞的杀伤,以及实体瘤细胞外的致密物理屏障、免疫抑制屏障等微环境限制了T细胞向实体瘤深处的浸润及杀伤功能的发挥,ACT对大多数实体瘤疗效不佳。研究人员认为,亟需通过学科交叉来发展针对实体瘤增效的新理念和新技术。
在最新发表的工作中,研究团队提出多维度协同改善细胞内凋亡抗性和细胞外微环境的新理念。在此基础上,他们提出利用近红外光照射(NIR)或聚焦超声(FUS)非侵入性策略带来的温热效应,激活基因编辑敲除肿瘤细胞抗凋亡基因(HSP70和BAG3),以及打破实体瘤的物理屏障和免疫抑制屏障。通过上述协同作用,在动物肿瘤模型上显著增强了T细胞的瘤内浸润和对肿瘤细胞的杀伤效果。
其中,
杏耀的体会 ,针对浅表肿瘤,研究团队发展了光驱动型基因编辑纳米器件(LEGEND),采用“纳米器件瘤周注射+NIR照射”的方式,2号站平台奖金多少?在黑色素瘤等小鼠肿瘤模型以及人源化的患者来源肿瘤异种移植模型上显著提升了肿瘤浸润T细胞和嵌合抗原受体T细胞两种过继回输T细胞疗法的治疗效果。针对深部腔内肿瘤,研究团队进一步发展了聚焦超声驱动型基因编辑纳米器件(FUGEND),采用“纳米器件静脉注射+FUS”的方式,在小鼠原位肝癌模型上同样证明了显著的ACT增效作用。
研究人员介绍,上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。鉴于该体系构建的通用性和灵活性,未来临床转化时可以按照不同治疗需求采用不同的基因编辑策略及非侵入操控方式。
浙江大学药学院陈小红博士、过程工程所王双副研究员、浙江大学药学院博士生陈宇轩为该论文共同第一作者,浙江大学药学院平渊教授、过程工程所魏炜研究员为共同通讯作者。